Reazioni elettrocicliche: conrotatoria e disrotatoria (definizione)
Guida essenziale alle reazioni elettrocicliche: conrotatoria vs disrotatoria, meccanica orbitale, regole di Woodward–Hoffmann e stereochimica per 4n/4n+2 π.
Definizione e concetto di base
I termini conrotatoria e disrotatoria descrivono due modalità stereochimiche alternative con cui può avvenire una reazione elettrociclica (un tipo di reazioni chimiche organiche). In una trasformazione elettrociclica un sistema coniugato di legami pi si apre o si chiude formando o rompendo un anello: la differenza tra le due modalità riguarda il senso di rotazione relativo dei sostituenti alle estremità del sistema pi.
- Modalità conrotatoria: i sostituenti posti alle estremità del sistema a doppio legame si muovono nella stessa direzione (entrambi in senso orario o entrambi in senso antiorario) durante la chiusura o l'apertura dell'anello.
- Modalità disrotatoria: i sostituenti ruotano in direzioni opposte (uno in senso orario e l'altro in senso antiorario).
Esempio illustrativo
Un esempio pratico è la conversione del trans‑cis‑trans‑2,4,6‑octatriene in cis‑dimetilcicloesadiene (rappresentata in alto nella figura presente nell'articolo). Per questo caso la meccanica orbitale impone una modalità disrotatoria. La ragione è che la simmetria dell'Highest Occupied Molecular Orbital (HOMO) dell'ottatriene richiede che gli orbitali pi terminali ruotino in direzioni opposte affinché le fasi degli orbitali coincidano nella formazione del nuovo legame sigma.

Ruolo della simmetria orbitale e regole generali
La predizione della modalità (conrotatoria o disrotatoria) si basa sulla conservazione della simmetria orbitale del sistema elettronico coinvolto, in particolare sull'orientazione e sulla fase dell'HOMO al momento della reazione. Le regole di Woodward-Hoffmann forniscono una linea guida pratica:
- Per reazioni termiche (a temperatura, senza eccitazione luminosa):
- sistemi con 4n + 2 elettroni π (n intero) procedono in modalità disrotatoria (es. 6π → disrotatoria);
- sistemi con 4n elettroni π procedono in modalità conrotatoria.
- Per reazioni fotochimiche (avviate per eccitazione elettronica con luce) le regole si invertono:
- 4n + 2 π → conrotatoria;
- 4n π → disrotatoria.
Queste predizioni derivano dal confronto tra la simmetria dell'HOMO e la simmetria richiesta per formare il nuovo legame sigma senza violare la conservazione della simmetria lungo il percorso della reazione. Per questo motivo le reazioni elettrocicliche sono spesso stereospecifiche.
Spiegazione qualitativa mediante l'HOMO
Una spiegazione intuitiva è guardare le fasi dell'HOMO sui due atomi terminali del sistema pi. Se le fasi terminali dell'HOMO hanno lo stesso segno, la loro sovrapposizione favorevole per formare un legame sigma richiede una particolare direzione relativa di rotazione; se hanno segni opposti, la direzione richiesta è l'altra. La necessità di mantenere la continuità di fase lungo la reazione determina dunque se la chiusura sarà conrotatoria o disrotatoria.
Importanza pratica
La distinzione tra le due modalità è fondamentale nella sintesi organica stereoselettiva: la modalità di chiusura influisce direttamente sulla stereochimica dei prodotti ciclici (configurazioni cis/trans dei sostituenti, ecc.). Comprendere se una reazione sarà termica o fotoindotta, e quanti elettroni π sono coinvolti, permette di prevedere il risultato stereochimico e progettare percorsi sintetici appropriati.
In sintesi: la scelta tra conrotatoria e disrotatoria non è casuale ma è imposta dalla simmetria degli orbitali coinvolti e dalle condizioni (termiche o fotochimiche) della reazione; le regole di Woodward-Hoffmann riassumono queste previsioni.
L'immagine seguente mostra anche la differenza tra reazioni conrotatorie e disrotatorie:
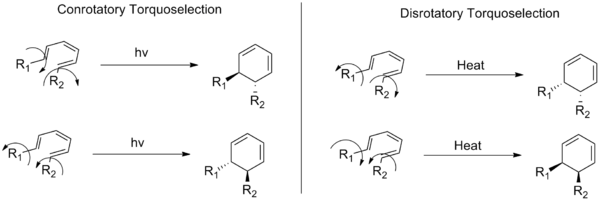
Modalità di rotazione conrotatoria e disrotatoria che mostrano ciascuna due possibili direzioni di rotazione che si traducono in coppie di enantiomeri per un generico sistema esatrieno.
Domande e risposte
D: Che cos'è una reazione elettrociclica?
R: Una reazione elettrociclica è un tipo di reazione chimica organica in cui un sistema di doppi legami coniugati si apre o si chiude per formare un anello.
D: Qual è la differenza tra modalità conrotatoria e disrotatoria?
R: In una modalità conrotatoria, i sostituenti situati alle estremità di un sistema di doppi legami coniugati si muovono nella stessa direzione (oraria o antioraria) durante l'apertura o la chiusura dell'anello. Al contrario, in una modalità disrotatoria, si muovono in direzioni opposte.
D: Come influisce la simmetria orbitale su queste reazioni?
R: La meccanica orbitale della reazione deve essere presa in considerazione per determinare se segue le regole conrotatorie o disrotatorie. Ad esempio, i sistemi contenenti 4n + 2 elettroni pi sono stereospecifici e seguono la regola conrotatoria a causa della conservazione della simmetria orbitale nei loro orbitali molecolari a massima occupazione (HOMO). I sistemi contenenti 4n elettroni pi mostrano la modalità disrotatoria opposta. Questo è vero anche per i riarrangiamenti di 4n + 2 elettroni pi (dove n è un numero intero) guidati dalla luce (fotoindotti). I riarrangiamenti fotoindotti di sistemi di 4n elettroni pi (dove il numero di elettroni è divisibile per 4) seguono la regola disrotatoria.
D: Cosa sono le regole di Woodward-Hoffmann?
R: Le regole di Woodward-Hoffmann riassumono diversi tipi di reazioni elettrocicliche e come sono influenzate da fattori come la simmetria orbitale e la presenza/assenza di energia luminosa.
D: Cosa mostra questa immagine?
R: L'immagine mostra un esempio di conversione da trans-cis-trans-2,4,6-ottatriene a cis-dimetilcicloesadiene e illustra come i sostituenti si muovono in modo diverso a seconda che seguano modalità conorotarie o disorotarie - rispettivamente in senso orario e antiorario, se visti dall'alto.
Cerca nell'enciclopedia