Legame covalente
I legami covalenti sono legami chimici tra due atomi non metallici. Un esempio è l'acqua, dove l'idrogeno (H) e l'ossigeno (O) si legano insieme per formare (H2O). Un guscio esterno completo di solito ha otto elettroni, o due nel caso dell'idrogeno o dell'elio. Gli elettroni di valenza sono gli elettroni che si trovano relativamente allentati nel guscio esterno dell'atomo. La struttura dei gusci di elettroni è determinata dalla meccanica quantistica).
Il numero di elettroni in un atomo è deciso dal numero di protoni nell'atomo. Gli elettroni orbitano intorno ai nuclei atomici, e sono come percorsi orbitali confusi intorno ad un nucleo atomico. Il primo strato ha fino a due elettroni. Gli strati successivi di solito ne contengono fino a otto. I legami covalenti sono formati da atomi che condividono elettroni di valenza.
Se per esempio un atomo avesse nove elettroni, le prime due orbite molto vicine al nucleo, le successive sette orbite un po' più lontane. I sette elettroni esterni sono meno stretti dei due elettroni interni perché sono più lontani dal nucleo a carica positiva. Se questo atomo si avvicina ad un altro atomo, con un elettrone allentato nel suo guscio esterno, un nuovo orbitale sarà disponibile per l'elettrone allentato. Questo nuovo orbitale dell'elettrone è legato ad entrambi i nuclei atomici e ha un livello di energia inferiore rispetto all'orbitale originale dell'elettrone. L'elettrone può saltare spontaneamente ad esso ed emettere un fotone con l'energia in eccesso. Ora abbiamo un elettrone che orbita attorno ad entrambi gli atomi, il che fa sì che l'atomo abbia una piccola carica positiva netta e l'altro atomo abbia una piccola carica negativa netta. I due atomi sono ora tenuti insieme dalla forza elettromagnetica di attrazione tra le cariche positive e negative. Questo è chiamato legame covalente. Per rompere questo legame è necessaria la stessa quantità di energia che è stata rilasciata quando si è formato.
Una molecola d'acqua è composta da un atomo di ossigeno e due atomi di idrogeno tenuti insieme da un legame covalente. In questo caso l'atomo di ossigeno condivide un elettrone con ogni atomo di idrogeno. Ciò significa che gli atomi di ossigeno hanno una piccola carica positiva netta e l'atomo di idrogeno ha una piccola carica negativa netta. Di conseguenza, gli atomi di ossigeno e di idrogeno sono attratti l'uno dall'altro a causa della forza elettromagnetica. Per questo motivo la molecola dell'acqua è una molecola polare: la sua carica non è distribuita uniformemente.
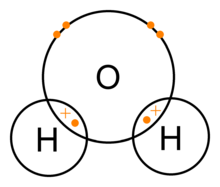
Legami covalenti dell'acqua (H2O)
Tipi di legame covalente
Gli orbitali atomici (ad eccezione degli orbitali s) producono diversi tipi di obbligazioni covalenti:
- Le obbligazioni Sigma (σ) sono le obbligazioni covalenti più forti. Hanno una sovrapposizione frontale di orbitali su due atomi diversi. Un singolo legame è di solito un legame σ.
- I legami Pi (π) sono più deboli e sono dovuti alla sovrapposizione laterale tra gli orbitali p (o d).
- Un doppio legame tra due atomi dato ha un legame σ e uno π, e
- un'obbligazione tripla ha un σ e due π.
I legami covalenti sono più deboli dei legami ionici e hanno un punto di fusione più basso. Sono anche generalmente poveri conduttori di elettricità e di calore.
Lunghezza del legame
In chimica, la lunghezza del legame è la misura delle dimensioni di un legame covalente. Poiché le molecole sono molto piccole, vengono misurate in picometri, ovvero circa un milionesimo di miliardesimo di metro.
La chimica delle molecole si spiega soprattutto con i loro legami, e i loro legami sono causati dalla struttura degli elettroni.
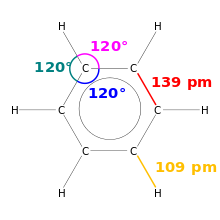
Disegno di benzene. Sono indicate le lunghezze di legame e gli angoli di legame.
Pagine correlate
- Valenza
Domande e risposte
D: Che cos'è un legame covalente?
R: Un legame covalente è un legame chimico tra due atomi non metallici, dove gli atomi condividono gli elettroni di valenza. Questo crea un orbitale di elettroni che è legato ad entrambi i nuclei atomici e ha un livello energetico inferiore rispetto all'orbitale di elettroni originale. Di conseguenza, l'atomo che ha fornito l'elettrone ha una piccola carica netta positiva e l'altro atomo ha una piccola carica netta negativa, che sono tenuti insieme da una forza elettromagnetica di attrazione tra cariche positive e negative.
D: Quanti elettroni ha di solito un atomo nel suo guscio esterno?
R: Il guscio esterno di un atomo contiene solitamente fino a otto elettroni, o due nel caso dell'idrogeno o dell'elio.
D: Cosa determina il numero di elettroni in un atomo?
R: Il numero di elettroni in un atomo è determinato dal numero di protoni presenti nell'atomo.
D: Come si formano i legami covalenti?
R: I legami covalenti si formano quando gli atomi si avvicinano l'uno all'altro e un elettrone non trattenuto da un atomo salta in un nuovo orbitale che è legato ad entrambi i nuclei atomici con un livello energetico più basso di prima. Questo fa sì che un atomo abbia una piccola carica netta positiva e un altro una piccola carica netta negativa, creando una forza elettromagnetica di attrazione tra loro.
D: Che tipo di molecola è l'acqua?
R: Le molecole d'acqua sono composte da un atomo di ossigeno e due atomi di idrogeno tenuti insieme da legami covalenti, il che la rende una molecola polare perché la sua carica non è distribuita in modo uniforme.
D: Dove orbitano gli elettroni intorno ai nuclei atomici?
R: Gli elettroni orbitano intorno ai nuclei atomici come percorsi orbitali sfocati.
Cerca nell'enciclopedia