Reazione elettrociclica
Nella chimica organica, una reazione elettrociclica è un tipo di reazione di riordinamento periciclico. La reazione è elettrociclica se il risultato è un legame pi greco che diventa un legame sigma o un legame sigma che diventa un legame pi greco. Le reazioni elettrocicliche hanno le seguenti proprietà:
- le reazioni elettrocicliche sono guidate dalla luce (fotoindotta) o dal calore (termica)
- il modo di reazione è determinato dal numero di elettroni pi nella parte con più legami pi
- una reazione elettrociclica può chiudere un anello (elettrocilizzazione) o aprire un anello
- la stereospecificità è determinata da una formazione di stato di transizione conrotatoria o disrotatoria, come previsto dalle regole di Woodward-Hoffmann.
La torquoselettività in una reazione elettrociclica si riferisce alla direzione di rotazione dei sostituti. Ad esempio, i sostituenti in una reazione che è conrotatoria possono ancora ruotare in due direzioni. Essa produce una miscela di due prodotti che sono l'immagine speculare l'uno dell'altro (prodotti enantiomerici). Una reazione che è torquoselettiva limita uno di questi sensi di rotazione (parzialmente o completamente) per produrre un prodotto in eccesso enantiomerico (dove uno stereoisomero è prodotto molto più dell'altro).
I chimici sono interessati alle reazioni elettrocicliche perché la geometria delle molecole conferma una serie di previsioni fatte dai chimici teorici. Esse confermano la conservazione della simmetria molecolare orbitale.
La reazione di ciclizzazione di Nazarov è una reazione elettrociclica che chiude un anello. Converte i divinilchetoni in ciclopentenoni. (Fu scoperta da Ivan Nikolaevich Nazarov (1906-1957).
Un esempio è la reazione termica di apertura ad anello del 3,4-dimetilciclobutene. L'isomero cis produce solo cis,trans-2,4-esadiene. Ma l'isomero trans dà il trans,trans diene:
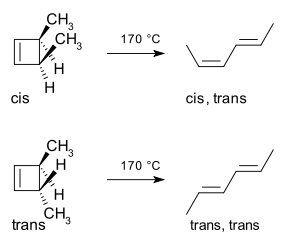
Il metodo della frontiera orbitale spiega come funziona questa reazione. Il legame sigma nel reagente si aprirà in modo che i p-orbitali risultanti avranno la stessa simmetria dell'orbitale molecolare più alto occupato (HOMO) del prodotto (un butadiene). Questo può accadere solo con un'apertura ad anello conrotatorio che si traduce in segni opposti per i due lobi alle estremità rotte dell'anello. (Un'apertura ad anello disrotatorio formerebbe un anti-bond.) Il seguente diagramma lo mostra:
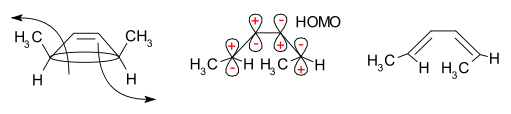
La stereospecificità del risultato dipende dal fatto che la reazione proceda attraverso un processo conrotatorio o disrotatorio.
Regole di Woodward-Hoffman
Le regole di Woodward-Hoffmann riguardano la conservazione della simmetria orbitale nelle reazioni elettrocicliche.

I diagrammi di correlazione collegano gli orbitali molecolari del reagente a quelli del prodotto che hanno la stessa simmetria. I diagrammi di correlazione possono essere disegnati per i due processi.
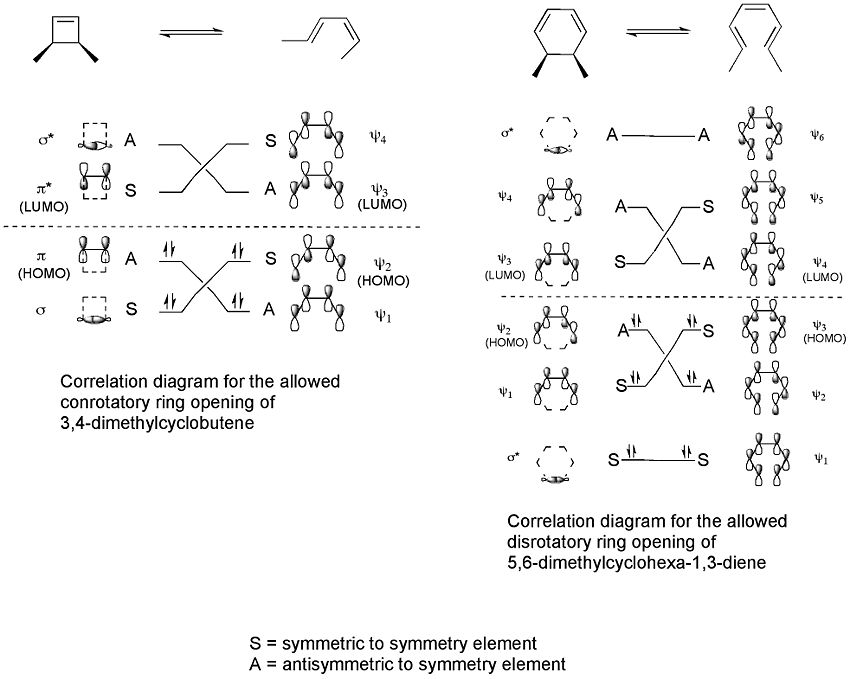
Questi diagrammi di correlazione indicano che solo un'apertura dell'anello conrotatorio di 3,4-dimetilciclobutene è "simmetria ammessa", mentre solo un'apertura dell'anello disrotatorio di 5,6-dimetilcicloesa-1,3-diene è "simmetria ammessa". Questo perché solo in questi casi si verificherebbe la massima sovrapposizione orbitale nello stato di transizione. Inoltre, il prodotto formato sarebbe in uno stato di terra piuttosto che in uno stato eccitato.
Teoria orbitale molecolare di frontiera
La teoria dell'orbitale molecolare di frontiera prevede che il legame sigma nell'anello si aprirà in modo tale che i p-orbitali risultanti avranno la stessa simmetria dell'HOMO del prodotto.
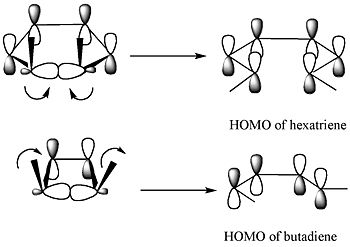
Il diagramma sopra riportato mostra due esempi. Per il 5,6-dimetilcicloesa-1,3-diene (riga superiore del diagramma), solo una modalità disrotatoria porterebbe a p-orbitali con la stessa simmetria dell'HOMO dell'esatriene. I due p-orbitali ruotano in direzioni opposte. Per il 3,4-dimetilciclobutene (riga inferiore del diagramma), solo una modalità conrotatoria porterebbe a p-orbitali con la stessa simmetria dell'HOMO del butadiene. I p-oribtali ruotano nella stessa direzione.
Elettrociclizzazioni a stato eccitato
La luce può muovere un elettrone fino ad uno stato di eccitazione che occupa un'orbita superiore. L'elettrone eccitato occuperà il LUMO, che ha un livello di energia più elevato rispetto al vecchio orbitale dell'elettrone. Se la luce apre l'anello di 3,4-dimetilciclobutene, l'elettrocilcilizzazione risultante si verificherebbe per mezzo di un modo disrotatorio invece di un modo conrotatorio. Il diagramma di correlazione per la reazione di apertura dell'anello di stato eccitato consentito mostra il perché:
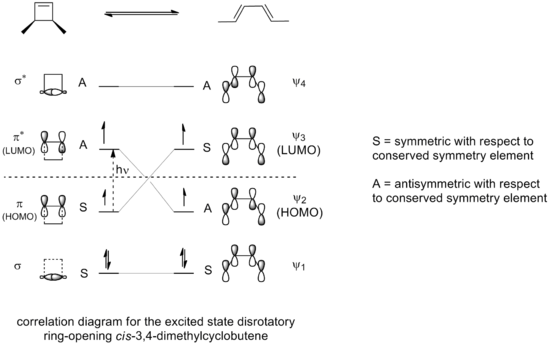
Solo una modalità disrotatoria, in cui la simmetria su un piano di riflessione viene mantenuta per tutta la reazione, porterebbe alla massima sovrapposizione orbitale nello stato di transizione. Inoltre, ancora una volta, questo porterebbe alla formazione di un prodotto che si trova in uno stato eccitato di stabilità paragonabile allo stato eccitato del composto reagente.
Reazioni elettrocicliche nei sistemi biologici
Le reazioni elettrocicliche si verificano frequentemente in natura. Una delle reazioni più comuni in natura è la biosintesi della vitamina D3.
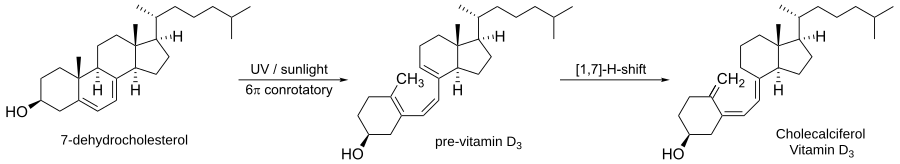
Il primo passo prevede l'apertura leggera dell'anello di 7-deidrocolesterolo per formare la pre-vitamina D3. Si tratta di una reazione elettrociclica conrotatoria fotochimica indotta fotochimicamente. Il secondo passo è uno spostamento di [1,7]-idruro per fare la vitamina D3.
Un altro esempio è nella proposta di biosintesi dell'aranotina, un'ossepina presente in natura, e dei suoi composti correlati.
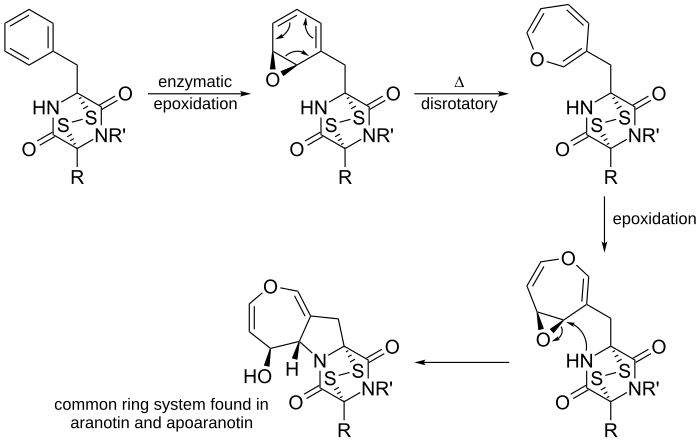
La fenilalanina è usata per produrre la diketopiperazina (non mostrata). Poi gli enzimi epossidici epossidato diketopiperazina per fare l'ossido di arene. Questo subisce una reazione di elettrocilizzazione di apertura anello disrotatorio 6π apertura elettrocilizzazione per produrre l'ossepina non ciclizzata. Dopo una seconda epossidazione dell'anello, l'azoto nucleofilo vicino attacca il carbonio elettrofilico, formando un anello a cinque membri. Il sistema ad anello risultante è un sistema ad anello comune che si trova nell'aranotina e nei suoi composti correlati.
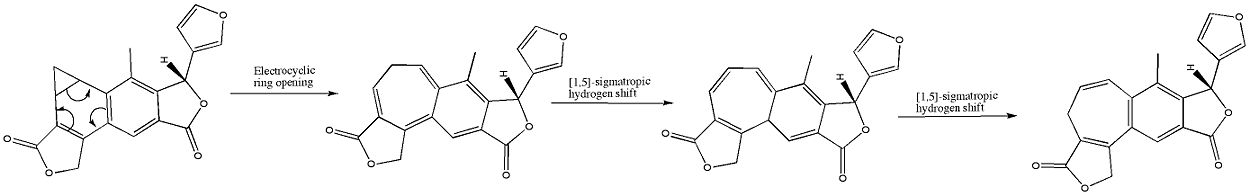
Il benzonorcaradiene diterpenoide (A) è stato riordinato nel benzocicloeptatriene diterpenoide isosalvipuberlin (B) mediante ebollizione di una soluzione di cloruro di metilene. Questa trasformazione può essere pensata come una reazione elettrociclica disrotatoria, seguita da due spostamenti di idrogeno soprafacciale 1,5-sigmatropico, come mostrato di seguito:
Ambito di applicazione
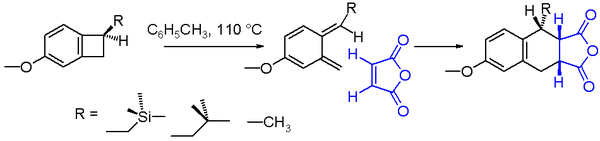
Un esempio di reazione elettrociclica è l'apertura ad anello termico conrotatorio del benzociclobutano. Il prodotto della reazione è un ortochinodimetano molto instabile. Questa molecola può essere intrappolata in un'aggiunta di endo endo con un forte dienofilo come l'anidride maleica all'addotto di Diels-Alder. Il rendimento chimico per l'apertura dell'anello del benzociclobutano raffigurato nello schema 2 dipende dalla natura del sostituto R. Con un solvente di reazione come il toluene e una temperatura di reazione di 110 °C, il rendimento aumenta passando da metile a isobutilmetile a trimetilsilmetile. L'aumento del tasso di reazione del composto trimetilsilililico può essere spiegato dall'iperconiugazione del silicio, poiché il legame βC-Si indebolisce il legame C-C del ciclobutano donando elettroni.
Una reazione biomimetica elettrociclica a cascata è stata scoperta in relazione all'isolamento e alla sintesi di alcuni acidi endiandrici:

Domande e risposte
D: Che cos'è una reazione elettrociclica?
R: Una reazione elettrociclica è un tipo di reazione di riarrangiamento periciclico in cui il risultato è un legame pi greco che diventa un legame sigma o un legame sigma che diventa un legame pi greco.
D: Come vengono guidate le reazioni elettrocicliche?
R: Le reazioni elettrocicliche sono guidate dalla luce (fotoindotta) o dal calore (termica).
D: In che modo il numero di elettroni pi influisce su una reazione elettrociclica?
R: Il numero di elettroni pi influisce sulla modalità di reazione in una reazione elettrociclica.
D: Cosa succede durante un processo di elettrociclaggio?
R: Durante un processo di elettrociclizzazione, un anello può essere chiuso.
D: Cosa determina la stereospecificità in una reazione elettrociclica?
R: La stereospecificità in una reazione elettrociclica è determinata dalla formazione di uno stato di transizione conrotatorio o disrotatorio, come previsto dalle regole di Woodward-Hoffmann.
D: Che cos'è la torquoselettività in relazione a una reazione elettrociclica?
R: La torquoselettività si riferisce alla direzione di rotazione dei sostituenti durante una reazione elettrociclica, che può produrre prodotti enantiomerici se procede attraverso un processo conrotatorio e un eccesso di enantiomero se procede attraverso un processo torquoselettivo.
D:Che tipo di esempio illustra come il metodo degli orbitali di frontiera spiega il funzionamento?
R:La reazione di apertura termica dell'anello del 3,4-dimetilciclobutene fornisce un esempio per illustrare come il metodo degli orbitali di frontiera spiega come funziona. Il legame sigma si aprirà in modo tale che gli orbitali p risultanti abbiano la stessa simmetria dell'orbitale molecolare a massima occupazione (HOMO) del prodotto (un butadiene). Questo avviene solo con l'apertura conrotatoria dell'anello, che comporta segni opposti per i due lobi alle estremità spezzate dell'anello, mentre con la disrotatoria si formerebbero degli anti-bond.
Cerca nell'enciclopedia