Isotopi dell'idrogeno
L'idrogeno ha tre isotopi principali: protio (1H), deuterio (2H) e trizio (3H). Questi isotopi si formano naturalmente in natura. Il prozio e il deuterio sono stabili. Il trizio è radioattivo e ha un'emivita di circa 12 anni. Gli scienziati hanno creato altri quattro isotopi dell'idrogeno (da 4H a 7H), ma questi isotopi sono molto instabili e non esistono naturalmente.
I principali isotopi dell'idrogeno sono unici perché sono gli unici isotopi che hanno un nome. Questi nomi sono ancora in uso oggi. Il deuterio e il trizio a volte hanno i loro propri simboli, D e T. Tuttavia, l'Unione internazionale di chimica pura e applicata non ama molto questi nomi, anche se sono spesso usati. Ci sono altri isotopi che avevano i loro nomi quando gli scienziati studiavano la radioattività. Ma i loro nomi non sono più usati oggi.
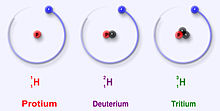
I tre isotopi più stabili dell'idrogeno
Prozio (idrogeno-1)
Il protio è l'isotopo più comune dell'idrogeno. Costituisce più del 99,98% di tutto l'idrogeno dell'universo. Si chiama protio perché il suo nucleo ha un solo protone. Il protio ha una massa atomica di 1,00782504(7) u. Il simbolo del protio è 1H.Il protone del protio non è mai decaduto in un'osservazione, quindi gli scienziati credono che il protio sia un isotopo stabile. Le nuove teorie della fisica delle particelle prevedono che un protone possa decadere, ma questo decadimento è molto lento. Si dice che il protone abbia un'emivita di 1036 anni. Se il decadimento del protone è vero, allora tutti gli altri nuclei che si dice siano stabili sono in realtà stabili solo a livello di osservazione, cioè sembrano stabili. Esperimenti recenti hanno dimostrato che se il decadimento del protone avviene, avrebbe un tempo di dimezzamento di 6,6 × 1033 anni.
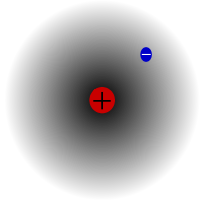
Il protio, l'isotopo più comune dell'idrogeno. È speciale perché è l'unico isotopo che non ha neutroni.
Deuterio (idrogeno-2)
Il deuterio, o 2H o a volte D, è un altro isotopo stabile dell'idrogeno. L'isotopo ha un protone e un neutrone. Costituisce circa lo 0,0026 - 0,0184% di tutti gli atomi di idrogeno sulla Terra. Il deuterio è meno presente nell'idrogeno gassoso sulla Terra ed è più presente nell'acqua di mare (0,015% o 150 ppm). Il deuterio non è radioattivo e non danneggia gli esseri viventi. Il deuterio può anche formare molecole di acqua. L'acqua che ha deuterio invece di protio è chiamata acqua pesante.
Trizio (idrogeno-3)
Il trizio (3H) è il radioisotopo più stabile dell'idrogeno. Cioè, di tutti gli isotopi radioattivi dell'idrogeno, il trizio è il meno radioattivo. Ha un protone e 2 neutroni nel suo nucleo. Il trizio decade attraverso il decadimento beta negativo e si trasforma in elio-3. Ha un'emivita di 12,32 anni.Il trizio si forma naturalmente dall'interazione tra i gas nell'atmosfera superiore e i raggi cosmici. Viene anche creato durante i test delle armi nucleari. Il trizio e il deuterio sono usati nella fusione nucleare D-T nelle stelle per emettere molta energia.
Domande e risposte
D: Quanti sono gli isotopi principali dell'idrogeno?
R: Esistono tre isotopi principali dell'idrogeno: il protio, il deuterio e il trizio.
D: Il prozio e il deuterio sono isotopi stabili?
R: Sì, il prozio e il deuterio sono isotopi stabili.
D: Qual è l'emivita del trizio?
R: Il trizio è radioattivo e ha un'emivita di circa 12 anni.
D: Quanti altri isotopi dell'idrogeno sono stati creati dagli scienziati?
R: Gli scienziati hanno creato altri quattro isotopi di idrogeno: da 4H a 7H.
D: Questi quattro isotopi di idrogeno aggiuntivi esistono in natura?
R: No, questi isotopi sono molto instabili e non esistono in natura.
D: Cosa rende unici gli isotopi principali dell'idrogeno?
R: Gli isotopi principali dell'idrogeno sono unici perché sono gli unici isotopi che hanno un nome.
D: Il deuterio e il trizio hanno dei simboli propri?
R: Sì, a volte il deuterio e il trizio hanno dei simboli propri: D e T. Tuttavia, l'Unione Internazionale di Chimica Pura e Applicata non ama molto questi nomi, anche se vengono spesso utilizzati.
Cerca nell'enciclopedia