Stato di transizione
In una reazione chimica, lo stato di transizione è il punto in cui c'è un valore massimo di energia. Questa energia è chiamata energia di attivazione. Quando due o più molecole si mescolano, si colpiscono a vicenda. Se si scontrano con abbastanza energia da passare attraverso lo stato di transizione, reagiranno e formeranno nuove molecole. Allo stato di transizione, si formano nuovi legami mentre quelli vecchi si rompono. In un grafico o in un disegno, lo stato di transizione è spesso segnato con il simbolo del doppio pugnale ‡.
È molto difficile studiare uno stato di transizione. Questo perché è così alto in energia che le molecole rimarranno in quella forma per un tempo molto breve, di solito femtosecondi. È importante non confondere gli stati di transizione con gli intermedi. Gli intermedi si trovano in punti minimi di energia, e possono vivere per un tempo molto lungo. Come uno stato di transizione, tuttavia, un intermedio si trova tra i reagenti e i prodotti di una reazione.
Lo studio degli stati di transizione è molto importante per capire i meccanismi di reazione. Ci sono teorie e programmi per computer che possono essere usati per calcolare l'aspetto dello stato di transizione. Questa è una parte della cinetica chimica.
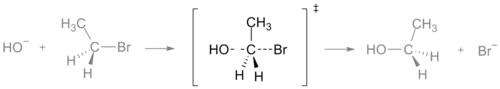
Lo stato di transizione di una reazione SN2
Domande e risposte
D: Che cos'è lo stato di transizione in una reazione chimica?
R: Lo stato di transizione è il punto in cui c'è un valore massimo di energia in una reazione chimica.
D: Che cos'è l'energia di attivazione in una reazione chimica?
R: L'energia necessaria affinché si verifichi una reazione si chiama energia di attivazione.
D: Cosa succede quando due o più molecole vengono mescolate in una reazione chimica?
R: Quando due o più molecole si mescolano, si colpiscono a vicenda. Se si colpiscono con un'energia sufficiente per passare attraverso lo stato di transizione, reagiscono e formano nuove molecole.
D: A cosa serve il simbolo del doppio pugnale (‡) in un grafico o in un disegno di una reazione chimica?
R: Il simbolo del doppio pugnale (‡) viene utilizzato per contrassegnare lo stato di transizione in un grafico o in un disegno di una reazione chimica.
D: Perché è difficile studiare lo stato di transizione in una reazione chimica?
R: È molto difficile studiare lo stato di transizione in una reazione chimica perché ha un'energia così alta che le molecole rimangono in quella forma per un tempo molto breve, di solito femtosecondi.
D: Che cos'è un intermedio in una reazione chimica?
R: Un intermedio è una molecola che si trova in punti minimi di energia in una reazione chimica e può vivere per un tempo molto lungo.
D: Perché lo studio degli stati di transizione è importante per comprendere i meccanismi di reazione?
R: Lo studio degli stati di transizione è importante per comprendere i meccanismi di reazione, perché aiuta a determinare come avviene una reazione e come controllarla o manipolarla.
Cerca nell'enciclopedia