Reazioni cheletropiche
Le reazioni cheletropiche sono un tipo di reazione periciclica in cui un atomo su uno dei reagenti ottiene due nuovi legami. Una reazione periciclica è una reazione che coinvolge uno stato di transizione con un array ciclico di atomi e un array ciclico associato di orbitali interagenti. Una riorganizzazione dei legami σ e π avviene in questa matrice ciclica.
Le reazioni cheletropiche sono una sottoclasse delle cicloaddizioni. Ciò che distingue le reazioni cheletropiche è che su uno dei reagenti, entrambi i nuovi legami sono fatti allo stesso atomo. Alcuni esempi sono mostrati a destra nella figura 1. Nel primo caso, il singolo atomo è l'atomo di carbonio nel gruppo carbonile. Quell'atomo di carbonio finisce nel monossido di carbonio. Il risultato finale è la creazione di due nuovi legami con un atomo. I primi due esempi sono conosciuti come "estrusioni cheletropiche" perché una piccola molecola stabile viene rilasciata nella reazione. La forza motrice di queste reazioni è spesso il beneficio entropico del rilascio di un gas (per esempio CO o N2).

Figura 1. Reazioni pericicliche
Analisi teorica
A causa della geometria delle molecole coinvolte nelle reazioni cheletropiche, esse confermano una serie di previsioni fatte dai chimici teorici. Le reazioni cheletropiche confermano la conservazione della simmetria degli orbitali molecolari.
Nello stato di transizione periciclico, una piccola molecola dona due elettroni all'anello. Due possibili geometrie possono spiegare la reazione. La piccola molecola può avvicinarsi in modo lineare o non lineare. Nell'approccio lineare, gli elettroni nell'orbitale della piccola molecola sono puntati direttamente sul sistema π della grande molecola. Nell'approccio non lineare, l'orbitale si avvicina con un angolo leggermente diverso. La capacità dei sistemi π di ruotare mentre la piccola molecola si avvicina è cruciale nella formazione di nuovi legami. La direzione della rotazione sarà diversa a seconda di quanti elettroni π ci sono nel sistema. Un diagramma di un frammento di due elettroni che si avvicina a un sistema π di quattro elettroni usando gli orbitali molecolari di frontiera è mostrato sotto. La rotazione sarà disrotatoria se la piccola molecola si avvicina linearmente e conrotatoria se la molecola si avvicina non linearmente. Disrotatorio e conrotatorio dicono come stanno ruotando i legami nel sistema π. Disrotatorio significa direzioni opposte mentre conrotatorio significa la stessa direzione. Questo è anche mostrato nel diagramma qui sotto.
Usando la regola di Huckel, si può dire se il sistema π è aromatico o antiaromatico. Se è aromatico, gli approcci lineari usano il moto disrotatorio mentre quelli non lineari usano il moto conrotatorio. L'opposto vale per un sistema anti-aromatico. Gli approcci lineari avranno un moto conrotatorio mentre quelli non lineari avranno un moto disrotatorio.
Reazioni cheletropiche che coinvolgono SO2
Termodinamica
Quando l'anidride solforosa reagisce con butadiene e isoprene, si ottengono due prodotti diversi. Il meccanismo di reazione controllerà cosa viene prodotto. Un prodotto cinetico e un prodotto termodinamico sono entrambi possibili. Si ottiene più prodotto termodinamico che prodotto cinetico. Il prodotto cinetico viene da una reazione di Diels-Alder, mentre una reazione cheletropica fa un prodotto più termodinamicamente stabile. La via cheletropica è usata di più perché produce un addotto più stabile a cinque anelli. Lo schema qui sotto mostra la differenza tra i due prodotti. Il percorso a sinistra mostra il prodotto termodinamico, mentre il percorso a destra mostra il prodotto cinetico. Suarez e Sordo lo hanno dimostrato nel 1995. L'hanno dimostrato sia con gli esperimenti che usando i calcoli di Gaussian.
Cinetica
Un esempio di questo è la reazione cheletropica di 1,3-dieni con anidride solforosa. I chimici hanno esaminato attentamente la cinetica di questa reazione. Nel 1976, Isaacs e Laila hanno misurato i fattori cinetici per l'aggiunta di biossido di zolfo ai derivati del butadiene. I tassi di aggiunta sono stati monitorati in benzene a 30 °C con un eccesso iniziale di diene di venti volte. Hanno usato uno spettrofotometro per studiare la luce a 320 nm per misurare la scomparsa di SO2. La reazione ha mostrato una "pseudo cinetica di primo ordine". I chimici scoprirono che i gruppi che sottraggono elettroni al diene diminuivano il tasso di reazione. Inoltre, la velocità di reazione era influenzata considerevolmente dagli effetti sterici dei 2-sostituenti, con gruppi più ingombranti che aumentavano la velocità di reazione. (In altre parole, più grande è il gruppo di atomi che pende dal secondo atomo di carbonio, più veloce è la reazione). Gli autori attribuiscono questo alla tendenza dei gruppi ingombranti a favorire la conformazione cisoide del diene che è essenziale per la reazione (vedi tabella sotto). Inoltre, i tassi a quattro temperature sono stati misurati per sette dei dieni. Da queste misure, i chimici hanno usato l'equazione di Arrhenius per calcolare l'entalpia di attivazione (ΔH‡) e l'entropia di attivazione (ΔS‡) per ogni reazione. Questo è stato uno dei primi sforzi importanti per studiare la cinetica di una reazione cheletropica.
| -Butadiene | 104 k /min-1 (30 °C) (± 1-2%) assoluto | 104 k /min-1 (30 °C) (± 1-2%) relativo | ΔH‡ /kcal mol-1 | ΔS‡ /cal mol-1 K-1 |
| 2-metile | 1.83 | 1.00 | 14.9 | -15 |
| 2-etile | 4.76 | 2.60 | 10.6 | -20 |
| 2-isopropilico | 13.0 | 7.38 | 12.5 | -17 |
| 2-terz-butile | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentile | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | N/A | N/A |
| 2-bromoetilico | 0.72 | 0.39 | N/A | N/A |
| 2-p-tolil | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenile | 17.3 | 9.45 | N/A | N/A |
| 2-(p-bromofenile) | 9.07 | 4.96 | N/A | N/A |
| 2,3-dimetile | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-metile | 0.18 | 0.10 | N/A | N/A |
| trans-1-metile | 0.69 | 0.38 | N/A | N/A |
| 1,2-dimetilene-cicloesano | 24.7 | 13.5 | 11.4 | -16 |
| 2-metil-1,1,4,4-d4 | 1.96 | N/A | N/A | N/A |
Monnat, Vogel e Sordo, nel 2002, hanno misurato la cinetica dell'aggiunta di biossido di zolfo a 1,2-dimetilidenecicloalcani. Hanno scritto che la reazione di 1,2-dimetilidenecicloesano con anidride solforosa può dare due prodotti diversi a seconda delle condizioni di reazione. La reazione produce la sultina corrispondente attraverso una reazione etero-Diels-Alder sotto controllo cinetico (≤ -60 °C), ma, sotto controllo termodinamico (≥ -40 °C), la reazione produce il sulfolene corrispondente attraverso una reazione cheletropica. L'entalpia di attivazione per la reazione etero-Diels-Alder è circa 2 kcal/mol più piccola di quella per la corrispondente reazione cheletropica. Il sulfolene è circa 10 kcal/mol più stabile della sultina isometrica in soluzione CH2Cl2/SO2.
Gli autori sono stati in grado di elaborare sperimentalmente una legge di tasso a 261,2 K per la reazione di 1,2-dimetilidenecicloesano con anidride solforosa per dare il corrispondente sulfolene. La reazione era di primo ordine in 1,2-dimetilidenecicloesano ma di secondo ordine in anidride solforosa (vedi sotto). Questo ha confermato una previsione dei chimici teorici basata su calcoli quantistici ab initio di alto livello. Usando metodi computazionali, gli autori hanno proposto una struttura di transizione per la reazione cheletropica di 1,2-dimetilidenecicloesano con anidride solforosa (vedi figura a destra). La reazione è di secondo ordine nell'anidride solforosa perché un'altra molecola di anidride solforosa probabilmente si lega allo stato di transizione per contribuire a stabilizzarlo. Risultati simili sono stati trovati in uno studio del 1995 di Suarez, Sordo e Sordo che ha usato calcoli ab initio per studiare il controllo cinetico e termodinamico della reazione del biossido di zolfo con 1,3-dieni.
d [ 3 ] d t = k 2 [ 1 ] [ S O 2 ] 2 {displaystyle {frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}
Effetti del solvente
L'effetto del solvente della reazione cheletropica di 3,4-dimethyl-2,5-dihydrothiophen-1,1-dioxide (mostrato a destra) è stato studiato cineticamente in 14 solventi. Le costanti di velocità di reazione della reazione in avanti e inversa, oltre alle costanti di equilibrio, sono risultate essere linearmente correlate con la scala di polarità del solvente ET(30).
Le reazioni sono state fatte a 120 °C e sono state studiate con la spettroscopia 1H-NMR della miscela di reazione. La velocità in avanti k1 è risultata diminuire di un fattore di 4,5 passando dal cicloesano al metanolo. La velocità inversa k-1 è risultata aumentare di un fattore di 53 passando dal cicloesano al metanolo, mentre la costante di equilibrio Keq è diminuita di un fattore di 140. Si suggerisce che ci sia un cambiamento della polarità durante il processo di attivazione, come evidenziato dalle relazioni tra l'equilibrio e i dati cinetici. Gli autori dicono che la reazione sembra essere influenzata dalla polarità del solvente, e questo può essere dimostrato dal cambiamento dei momenti di dipolo quando si passa dal reagente allo stato di transizione al prodotto. Gli autori affermano anche che la reazione cheletropica non sembra essere influenzata né dall'acidità né dalla basicità del solvente.
I risultati di questo studio portano gli autori ad aspettarsi i seguenti comportamenti:
1. Il cambiamento della polarità del solvente influenzerà il tasso meno dell'equilibrio.
2. Le costanti di tasso saranno caratterizzate da un effetto opposto sulla polarità: k1 diminuirà leggermente con l'aumento di ET(30), e k-1 aumenterà nelle stesse condizioni.
3. L'effetto su k-1 sarà maggiore che su k1.

Reazione di 1,2-Dimethylidenecyclohexane con SO2 dà una Sultina attraverso una reazione Hetero-Diels-Alder sotto controllo cinetico o un Sulfolene attraverso una reazione Cheletropic sotto controllo termodinamico

Stato di transizione proposto per la reazione di 1,2-Dimethylidenecyclohexane con SO2 per dare un sulfolene attraverso una reazione cheletropica
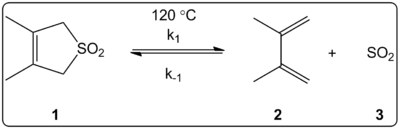
Reazione cheletropica studiata in vari solventi
Aggiunte di carbeni agli alcheni
Una delle reazioni cheletropiche più importanti a livello sintetico è l'aggiunta di un carbene singoletto a un alchene per fare un ciclopropano (vedi figura a sinistra). Un carbene è una molecola neutra che contiene un carbonio divalente con sei elettroni nel suo guscio di valenza. Per questo motivo, i carbeni sono elettrofili altamente reattivi e vengono generati come intermedi di reazione. Un carbene singoletto contiene un orbitale p vuoto e un orbitale ibrido più o meno sp2 che ha due elettroni. I carbeni singoletto si aggiungono stereospecificamente agli alcheni, e la stereochimica dell'alchene viene mantenuta nel prodotto ciclopropano. Il meccanismo per l'aggiunta di un carbene ad un alchene è una cicloaddizione concertata [2+1] (vedi figura). I carbeni derivati dal cloroformio o dal bromoformio possono essere usati per aggiungere CX2 a un alchene per dare un dialociclopropano, mentre il reagente di Simmons-Smith aggiunge CH2.
L'interazione dell'orbitale π del carbene riempito con il sistema π dell'alchene crea un sistema a quattro elettroni e favorisce un approccio non lineare. È anche favorevole a mescolare l'orbitale p vuoto del carbene con l'orbitale π pieno dell'alchene. La miscelazione favorevole avviene attraverso un approccio non lineare (vedi figura 2 a destra). Tuttavia, mentre la teoria favorisce chiaramente un approccio non lineare, non ci sono ovvie implicazioni sperimentali per un approccio lineare o non lineare.

Aggiunta di un carbene a un alchene per formare un ciclopropano

Figura 2. A) Gli orbitali per i carbeni singoletto B) Approccio non lineare di a) orbitale sp2 del carbene e b) orbitale p del carbene
Domande e risposte
D: Che cos'è una reazione cheletropica?
R: La reazione cheletropica è un tipo di reazione periciclica in cui un atomo su uno dei reagenti ottiene due nuovi legami.
D: Che cos'è una reazione periciclica?
R: Una reazione periciclica è una reazione che coinvolge uno stato di transizione con una serie ciclica di atomi e una serie ciclica associata di orbitali interagenti, in cui si verifica una riorganizzazione dei legami َ e ً.
D: In cosa differisce da altri tipi di reazioni?
R: Le reazioni cheletropiche sono una sottoclasse di cicloaddizioni e ciò che le distingue da altri tipi di reazioni è che su uno dei reagenti, entrambi i nuovi legami vengono creati con lo stesso atomo.
D: Quali sono alcuni esempi?
R: Gli esempi includono le "estrusioni cheletropiche", come quando il singolo atomo del gruppo carbonilico finisce nel monossido di carbonio.
D: Cosa guida queste reazioni?
R: La forza trainante di queste reazioni è spesso il vantaggio entropico del rilascio di un gas (ad esempio CO o N2).
D: La Figura 1 è correlata alle reazioni cheletropiche? R: Sì, la Figura 1 mostra esempi di reazioni cheletropiche.
Cerca nell'enciclopedia
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)