Carbocation
Un carbocation è uno ione con un atomo di carbonio caricato positivamente. L'atomo di carbonio carico in un carbocation è un "sestetto" (cioè, ha solo sei elettroni nel suo guscio di valenza esterno invece di otto elettroni di valenza). Gli atomi di carbonio con otto elettroni di valenza hanno la massima stabilità (regola dell'ottetto). Pertanto, i carbocationi sono spesso reattivi, cercando di riempire l'ottetto di elettroni di valenza e di riacquistare una carica neutra. La logica direbbe che i carbocation hanno un'ibridazione sp3 con un orbitale sp3 vuoto che dà una carica positiva. Tuttavia, la reattività di un carbocation assomiglia più da vicino all'ibridazione sp2 con una geometria molecolare trigonale planare.
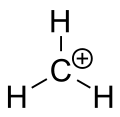
Ione carbenium del metano

catione terz-butilico, dimostrando la geometria planare
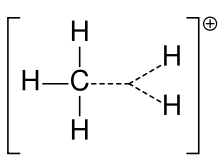
Ione carbonio del metano
Definizioni
Un carbocation è stato precedentemente chiamato spesso uno ione carbonium, ma i chimici si interrogano sul significato esatto. Nella chimica attuale, un carbocation è qualsiasi atomo di carbonio caricato positivamente. Sono stati suggeriti due tipi speciali: gli ioni carbenio sono trivalenti e gli ioni carbonio sono pentavalenti o esavalenti. I libri di testo a livello universitario discutono i carbocationi solo come se fossero ioni di carbenio, o discutono i carbocationi con un riferimento fugace alla vecchia frase di ione carbonium o ioni carbenium e carbonium. Un libro di testo rimane ancora oggi con il vecchio nome di ione carbonium per lo ione carbenium e riserva la frase ione carbonium ipervalente per CH5+.
Storia
Nel 1891, G. Merling riferì di aver aggiunto bromo al tropilidene (cicloeptatriene) e di aver riscaldato il prodotto per ottenere un materiale cristallino, solubile in acqua, C
7H
7Br. Egli non suggerì una struttura per esso; tuttavia Doering e Knox dimostrarono in modo convincente che si trattava di bromuro di tropilo (cicloeptatrienile). Questo ione è previsto essere aromatico dalla regola di Hückel.
Nel 1902, Norris e Kehrman scoprirono indipendentemente che il trifenilmetanolo incolore dava soluzioni giallo intenso in acido solforico concentrato. Il cloruro di trifenilmetile formava similmente complessi arancioni con cloruri di alluminio e di stagno. Nel 1902, Adolf von Baeyer riconobbe il carattere di sale dei composti formati.
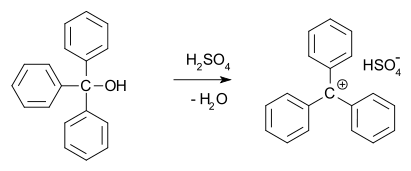
Ha chiamato la relazione tra il colore e la formazione del sale alocromia di cui il verde malachite è un primo esempio.
Le carbocationi sono intermedi reattivi in molte reazioni organiche. Questa idea, proposta per la prima volta da Julius Stieglitz nel 1899, fu ulteriormente sviluppata da Hans Meerwein nel suo studio del 1922 sul riarrangiamento Wagner-Meerwein. I carbocationi furono anche trovati coinvolti nella reazioneSN1, la reazione E1, e in reazioni di riarrangiamento come lo spostamento 1,2 di Whitmore. L'establishment chimico era riluttante ad accettare la nozione di carbocation e per molto tempo il Journal of the American Chemical Society rifiutò gli articoli che li menzionavano.
Il primo spettro NMR di un carbocation stabile in soluzione fu pubblicato da Doering et al. nel 1958. Si trattava dello ione eptametilbenzenonio, ottenuto trattando l'esametilbenzene con cloruro di metile e cloruro di alluminio. Il catione stabile 7-norbornadienile fu preparato da Story et al. nel 1960 facendo reagire il cloruro di norbornadienile con tetrafluoroborato d'argento in biossido di zolfo a -80 °C. Lo spettro NMR ha stabilito che era non-classicamente bridged (il primo ione stabile non-classico osservato).
Nel 1962, Olah osservò direttamente il carbocatione terz-butilico tramite risonanza magnetica nucleare come specie stabile sciogliendo il fluoruro di terz-butile in acido magico. La NMR del catione norbornilico è stata riportata per la prima volta da Schleyer et al. ed è stato dimostrato che subisce il proton-scrambling sopra una barriera da Saunders et al.
Proprietà
In chimica organica, un carbocatione è spesso il bersaglio di un attacco nucleofilo da parte di nucleofili come ioni ossidrile (OH-) o ioni alogeni.
I carbocationi sono classificati come primari, secondari o terziari a seconda del numero di atomi di carbonio legati al carbonio ionizzato. I carbocationi primari hanno uno o zero carboni legati al carbonio ionizzato, i carbocationi secondari hanno due carboni legati al carbonio ionizzato e i carbocationi terziari hanno tre carboni legati al carbonio ionizzato.
La stabilità del carbocation aumenta con il numero di gruppi alchilici legati al carbonio portatore di carica. I carbocationi terziari sono più stabili (e si formano più facilmente) dei carbocationi secondari; i carbocationi primari sono altamente instabili perché, mentre i carboni ionizzati di ordine superiore sono stabilizzati dall'iperconiugazione, i carboni non sostituiti (primari) non lo sono. Pertanto, reazioni come la reazioneSN1 e la reazione di eliminazione E1 normalmente non avvengono se si forma un carbocatione primario. Un'eccezione a questo si verifica quando c'è un doppio legame carbonio-carbonio vicino al carbonio ionizzato. Tali cationi come il catione allile CH2=CH-CH2+ e il catione benzile C6H5-CH2+ sono più stabili della maggior parte degli altri carbocationi. Le molecole che possono formare carbocationi allilici o benzilici sono particolarmente reattive.
I carbocationi subiscono reazioni di riarrangiamento da strutture meno stabili a strutture altrettanto stabili o più stabili con costanti di tasso in eccesso di 109/sec. Questo fatto complica i percorsi sintetici di molti composti. Per esempio, quando il 3-pentanolo viene riscaldato con HCl acquoso, il carbocatione 3-pentile inizialmente formato si riarrangia in una miscela statistica di 3-pentile e 2-pentile. Questi cationi reagiscono con lo ione cloruro per produrre circa 1/3 di 3-cloropentano e 2/3 di 2-cloropentano.
Alcuni carbocationi come il catione norbornyl mostrano un legame a tre centri più o meno simmetrico. I cationi di questo tipo sono stati indicati come ioni non classici. La differenza di energia tra i carbocationi "classici" e gli isomeri "non classici" è spesso molto piccola, e c'è generalmente poca o nessuna energia di attivazione coinvolta nella transizione tra le strutture "classiche" e "non classiche". La forma "non classica" del carbocatione 2-butile è essenzialmente 2-butene con un protone direttamente sopra il centro di quello che sarebbe il doppio legame carbonio-carbonio. I carbocationi "non classici" erano un tempo oggetto di grandi controversie. Uno dei più grandi contributi di George Olah alla chimica è stato risolvere questa controversia.
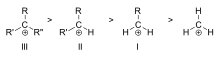
Ordine di stabilità di esempi di carbocationi alchilici terziari (III), secondari (II) e primari (I)
Carbocationi specifici
I cationi ciclopropilcarbinilici possono essere studiati tramite NMR:
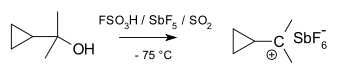
Nello spettro NMR di un derivato dimetilico, si trovano due segnali non equivalenti per i due gruppi metilici che indicano che la conformazione molecolare di questo catione non è perpendicolare (come in A) ma è bisecata (come in B) con il p-orbitale vuoto e il sistema di anelli ciclopropilici nello stesso piano:
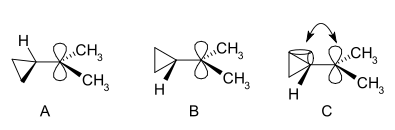
In termini di teoria dei legami piegati, questa preferenza è spiegata assumendo una sovrapposizione orbitale favorevole tra i legami piegati del ciclopropano riempiti e l'orbitale p vuoto.
Domande e risposte
D: Che cos'è un carbocatione?
R: Un carbocatione è uno ione con un atomo di carbonio con carica positiva.
D: Qual è il guscio di valenza esterno di un carbocation?
R: Il guscio di valenza esterno di un carbocatione ha solo sei elettroni invece degli otto elettroni di valenza stabili.
D: Perché i carbocationi sono spesso reattivi?
R: I carbocationi sono spesso reattivi perché cercano di riempire l'ottetto di elettroni di valenza e di riacquistare una carica neutra.
D: Qual è la stabilità massima degli atomi di carbonio?
R: La stabilità massima degli atomi di carbonio si ottiene quando hanno otto elettroni di valenza.
D: Che cos'è un sestetto in chimica?
R: Un sestetto è un termine utilizzato per descrivere un atomo di carbonio in un carbocation che ha solo sei elettroni nel suo guscio di valenza esterno, invece degli otto elettroni di valenza stabili.
D: Qual è l'ibridazione e la geometria molecolare di un carbocation?
R: Sebbene la logica suggerirebbe che i carbocationi abbiano un'ibridazione sp3 con un orbitale sp3 vuoto che conferisce una carica positiva, la loro reattività assomiglia più strettamente all'ibridazione sp2 con una geometria molecolare trigonale planare.
D: Che cos'è la regola dell'ottetto?
R: La regola dell'ottetto è un principio della chimica che afferma che gli atomi tendono a formare legami chimici con altri atomi che consentono ad entrambi gli atomi di avere una serie stabile di otto elettroni di valenza.
Cerca nell'enciclopedia