Nucleofilo
Un nucleofilo è una specie che dona una coppia di elettroni a un elettrofilo per formare un legame chimico in una reazione. Tutte le molecole o gli ioni con una coppia libera di elettroni possono essere nucleofili. Questa coppia di elettroni è chiamata coppia solitaria. Poiché i nucleofili donano elettroni, rientrano nella definizione di basi di Lewis.
La nucleofilia descrive l'attrazione di un nucleofilo verso i nuclei. La nucleofilia, a volte indicata come forza nucleofila, si riferisce al carattere nucleofilo di una sostanza ed è spesso usata per confrontare l'attrazione degli atomi.
Le reazioni nucleofile neutre con solventi come alcoli e acqua sono chiamate "solvolisi". I nucleofili possono partecipare a reazioni di sostituzione nucleofila. In queste reazioni, un nucleofilo viene attratto da una carica positiva totale o parziale.
Storia
I termini nucleofilo ed elettrofilo furono introdotti da Christopher Kelk Ingold nel 1929, sostituendo i termini cationoide e anionoide proposti precedentemente da A. J. Lapworth nel 1925.
La parola nucleofilo deriva da nucleo e dalla parola greca φιλος, philos per amore.
Proprietà
In generale, all'interno di una riga della tavola periodica, più lo ione è basico (più alto è il pKa dell'acido coniugato) più è reattivo come nucleofilo. In un dato gruppo, la polarizzabilità è più importante nella determinazione della nucleofilia. In altre parole, più è facile distorcere la nuvola di elettroni intorno a un atomo o una molecola, più facilmente reagirà. Per esempio, lo ione ioduro (I-) è più nucleofilo dello ione fluoruro (F-).
Tipi di nucleofili
Esempi di nucleofili sono anioni come Cl-, o un composto con una coppia solitaria di elettroni come NH3 (ammoniaca).
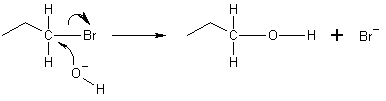
Nell'esempio qui sotto, l'ossigeno dello ione idrossido dona una coppia di elettroni per legarsi al carbonio alla fine della molecola di bromopropano. Il legame tra il carbonio e il bromo subisce quindi una fissione eterolitica, con l'atomo di bromo che prende l'elettrone donato e diventa lo ione bromuro (Br-). Questa è una reazioneSN2 che avviene per attacco posteriore. Ciò significa che lo ione idrossido attacca l'atomo di carbonio dall'altro lato, esattamente di fronte allo ione bromo. A causa di questo attacco posteriore, le reazioni SN2 provocano un'inversione della configurazione dell'elettrofilo. Se l'elettrofilo è chirale, tipicamente mantiene la sua chiralità, anche se la configurazione del prodotto SN2 è capovolta rispetto a quella dell'elettrofilo originale (inversione di Walden).
Un nucleofilo ambidestro è uno che può attaccare da due o più posti, risultando in due o più prodotti. Per esempio, lo ione tiocianato (SCN-) può attaccare sia dalla S che dalla N. Per questo motivo, la reazioneSN2 di un alogenuro alchilico con SCN- spesso porta ad una miscela di RSCN (un alchil tiocianato) e RNCS (un alchil isotiocianato). Miscele simili avverranno nella sintesi del nitrile di Kolbe.
Nucleofili del carbonio
Gli alogenuri metallici alchilici sono nucleofili del carbonio che si trovano nella reazione di Grignard, nella reazione di Blaise, nella reazione Reformatsky e nella reazione di Barbier, nei reagenti organolitici e negli anioni di un alchene terminale.
Gli enoli sono anche nucleofili del carbonio. La formazione di un enolo è catalizzata da un acido o da una base. Gli enoli sono nucleofili ambidenti, ma, in generale, nucleofili all'atomo di carbonio vicino ai carboni con doppio legame (atomo di carbonio alfa). Gli enoli sono comunemente usati nelle reazioni di condensazione, comprese la condensazione di Claisen e le reazioni di condensazione dell'aldolo.
Nucleofili dell'ossigeno
Esempi di nucleofili dell'ossigeno sono l'acqua (H2O), l'anione idrossido, gli alcoli, gli anioni alcossidi, il perossido di idrogeno e gli anioni carbossilati.
Nucleofili dello zolfo
Tra i nucleofili dello zolfo, l'idrogeno solforato e i suoi sali, i tioli (RSH), gli anioni tiolati (RS-), gli anioni degli acidi tiolcarbossilici (RC(O)-S-) e gli anioni dei ditiocarbonati (RO-C(S)-S-) e dei ditiocarbammati (R2N-C(S)-S-) sono utilizzati più spesso.
In generale, lo zolfo è molto nucleofilo a causa delle sue grandi dimensioni, che lo rendono facilmente polarizzabile, e le sue coppie solitarie di elettroni sono facilmente accessibili.
Nucleofili dell'azoto
I nucleofili dell'azoto includono ammoniaca, azide, ammine e nitriti.
Pagine correlate
- Elettrofilo
- Base Lewis
Domande e risposte
D: Che cos'è un nucleofilo?
R: Un nucleofilo è una specie che dona una coppia di elettroni ad un elettrofilo per formare un legame chimico in una reazione.
D: Quali tipi di molecole o ioni possono essere nucleofili?
R: Tutte le molecole o gli ioni con una coppia libera di elettroni possono essere nucleofili.
D: Come si chiama la coppia di elettroni che i nucleofili donano?
R: La coppia di elettroni si chiama coppia solitaria.
D: In quale categoria rientrano i nucleofili?
R: I nucleofili rientrano nella categoria delle basi di Lewis perché donano elettroni.
D: Cosa descrive il termine "nucleofilo"?
R: Il termine "nucleofilo" descrive l'attrazione di un nucleofilo verso i nuclei.
D: A cosa si riferisce il termine "nucleofilia"?
R: Il termine "nucleofilia" si riferisce al carattere nucleofilo di una sostanza e viene spesso utilizzato per confrontare l'attrazione degli atomi.
D: Cosa sono le reazioni di "solvolisi"?
R: Le reazioni nucleofile neutre con solventi come gli alcoli e l'acqua sono chiamate "solvolisi".
Cerca nell'enciclopedia