Reazione SN2
La reazione SN2 (conosciuta anche come sostituzione nucleofila bimolecolare) è una reazione di sostituzione in chimica organica. È un tipo di sostituzione nucleofila, dove una coppia solitaria di un nucleofilo attacca un centro elettrofilo carente di elettroni e si lega ad esso. Questo espelle un altro gruppo chiamato "gruppo uscente". Quindi, il gruppo entrante sostituisce il gruppo uscente in un solo passo. Poiché due specie reagenti sono coinvolte nella fase lenta e determinante della reazione, questo porta al nome di sostituzione nucleofila bimolecolare, o SN2. Tra i chimici inorganici, la reazione SN2 è spesso conosciuta come meccanismo di scambio.
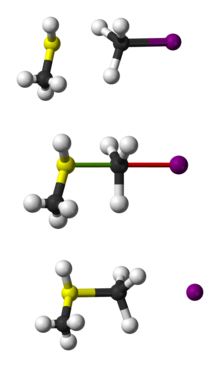
Rappresentazione a sfera della reazione SN2 di CH3SH con CH3I
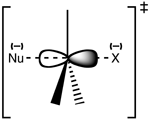
Struttura dello stato di transizione SN2
Meccanismo di reazione
La reazione avviene più spesso in un centro di carbonio alifatico sp3 con un gruppo uscente stabile ed elettronegativo attaccato ad esso - 'X' - spesso un atomo di alogenuro. La rottura del legame C-X e la formazione del nuovo legame C-Nu avvengono simultaneamente per formare uno stato di transizione in cui il carbonio sotto attacco nucleofilo è pentacoordinato e approssimativamente ibridato sp2. Il nucleofilo attacca il carbonio a 180° rispetto al gruppo uscente, poiché questo fornisce la migliore sovrapposizione tra la coppia solitaria del nucleofilo e l'orbitale di antibonding C-X σ*. Il gruppo uscente viene quindi spinto fuori dal lato opposto e si forma il prodotto.
Se il substrato sotto attacco nucleofilo è chirale, questo può portare, anche se non necessariamente, a un'inversione della stereochimica, chiamata inversione di Walden.
In un esempio di reazione SN2, l'attacco di OH- (il nucleofilo) su un bromoetano (l'elettrofilo) produce etanolo, con il bromuro espulso come gruppo uscente:
Una reazione SN2 si verifica se la via di attacco posteriore non è bloccata da altri atomi nella molecola (ostacolata stericamente dai sostituenti sul substrato). Quindi, questo meccanismo si verifica di solito in un centro di carbonio primario non ostacolato. Se c'è un affollamento sterico sul substrato vicino al gruppo lasciante, come ad esempio in un centro di carbonio terziario, la sostituzione utilizzerà un meccanismo SN1 piuttosto che SN2, (un SN1 sarebbe anche più probabile con molecole bloccate perché si potrebbe formare un intermediario carbocatione sufficientemente stabile).
Nella chimica di coordinazione, la sostituzione associativa procede con un meccanismo simile alla SN2.
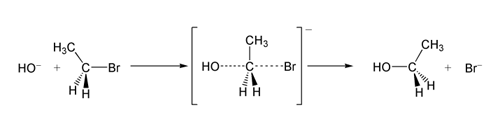
Reazione SN2 di bromoetano con ione idrossido.
Fattori che influenzano la velocità della reazione
Quattro fattori influenzano la velocità della reazione:
- Substrato. Il substrato gioca il ruolo più importante nel determinare la velocità della reazione. Questo perché il nucleofilo attacca dalla parte posteriore del substrato, rompendo così il legame carbonio-gruppo lasciante e formando il legame carbonio-nucleofilo. Quindi, per massimizzare la velocità della reazione SN2, la parte posteriore del substrato deve essere il più possibile priva di ostacoli. In generale, questo significa che i substrati metilici e primari reagiscono più velocemente, seguiti dai substrati secondari. I substrati terziari non partecipano alle reazioni SN2, a causa dell'ostacolo sterico.
- Nucleofilo. Come il substrato, l'ostacolo sterico influenza la forza del nucleofilo. L'anione metossido, per esempio, è sia una base forte che un nucleofilo perché è un nucleofilo metilico, ed è quindi molto poco ostacolato. Il tetra-butossido, d'altra parte, è una base forte, ma un povero nucleofilo, a causa dei suoi tre gruppi metilici che ostacolano il suo approccio al carbonio. La forza dei nucleofili è anche influenzata dalla carica e dall'elettronegatività: la nucleofilia aumenta con l'aumentare della carica negativa e la diminuzione dell'elettronegatività. Per esempio, OH- è un nucleofilo migliore dell'acqua, e I- è un nucleofilo migliore di Br- (in solventi protici polari). In un solvente polare aprotico, la nucleofilia aumenta su una colonna della tavola periodica, poiché non c'è legame idrogeno tra il solvente e il nucleofilo. In questo caso, la nucleofilia rispecchia la basicità. I- sarebbe quindi un nucleofilo più debole di Br- perché è una base più debole.
- Solvente. Il solvente influenza la velocità di reazione perché i solventi possono circondare o meno un nucleofilo, ostacolando o meno il suo avvicinamento all'atomo di carbonio. I solventi polari aprotici, come il tetraidrofurano, sono solventi migliori per questa reazione rispetto ai solventi polari protidici perché i solventi polari protidici saranno solvatati dal solvente che si lega a idrogeno al nucleofilo. Questo gli impedisce di attaccare il carbonio con il gruppo di partenza.
- Gruppo lasciante. Il gruppo lasciante influenza la velocità di reazione. Più il gruppo lasciante è stabile, più è probabile che prenda i due elettroni del suo gruppo lasciante al carbonio quando il nucleofilo attacca il carbonio. Pertanto, più debole è il gruppo lasciante come base coniugata, migliore è il gruppo lasciante. Allo stesso modo, più forte è il suo acido corrispondente, migliore è il gruppo lasciante. Esempi di buoni gruppi lascianti sono gli alogenuri (tranne il fluoruro) e il tosilato. Ma HO- e H2N- non sono buoni gruppi lascianti.
Cinetica della reazione
La velocità di una reazione SN2 è del secondo ordine, poiché il passo che determina la velocità dipende dalla concentrazione del nucleofilo, [Nu-] e dalla concentrazione del substrato, [RX].
r = k[RX][Nu-]
Questa è una differenza chiave tra i meccanismi SN1 e SN2. Nella reazione SN1, il nucleofilo attacca dopo che il passo limitante è finito. Ma in una reazione SN2, il nucleofilo forza il gruppo uscente nella fase limitante. In altre parole, la velocità delle reazioni SN1 dipende solo dalla concentrazione del substrato, mentre la velocità della reazione SN2 dipende dalla concentrazione sia del substrato che del nucleofilo. Nei casi in cui entrambi i meccanismi sono possibili (per esempio in un centro di carbonio secondario), il meccanismo dipende dal solvente, dalla temperatura, dalla concentrazione del nucleofilo o dal gruppo uscente.
Le reazioni SN2 sono generalmente favorite negli alogenuri alchilici primari o secondari con un solvente aprotico. Si verificano ad un tasso trascurabile negli alogenuri alchilici terziari a causa dell'ostacolo sterico.
SN2 e SN1 sono due estremi di una scala mobile di reazioni. È possibile trovare molte reazioni che mostrano entrambi i caratteri SN2 e SN1 nei loro meccanismi. Per esempio, è possibile ottenere una coppia di ioni di contatto formata da un alogenuro alchilico in cui gli ioni non sono completamente separati. Quando questi subiscono la sostituzione, la stereochimica sarà invertita (come in SN2) per molte delle molecole che reagiscono, ma alcune possono mostrare il mantenimento della configurazione. Le reazioni SN2 sono più comuni delle reazioni SN1.
E2 competizione
Una reazione collaterale comune che ha luogo con le reazioni SN2 è l'eliminazione E2: l'anione in entrata può agire come una base piuttosto che come un nucleofilo, rimuovendo un protone e portando alla formazione dell'alchene. Questo effetto può essere dimostrato nella reazione in fase gassosa tra un solfonato e un semplice bromuro di alchile che avviene all'interno di uno spettrometro di massa:

Con il bromuro di etile, il prodotto di reazione è prevalentemente il prodotto di sostituzione. Quando l'ostacolo sterico intorno al centro elettrofilo aumenta, come con il bromuro di isobutile, la sostituzione è sfavorita e l'eliminazione è la reazione predominante. Altri fattori che favoriscono l'eliminazione sono la forza della base. Con il substrato di benzoato meno basico, l'isopropil bromuro reagisce con il 55% di sostituzione. In generale, le reazioni in fase gassosa e quelle in fase di soluzione di questo tipo seguono le stesse tendenze, anche se nella prima, gli effetti del solvente vengono abbandonati.
Meccanismo della rotatoria
Uno sviluppo che ha attirato l'attenzione nel 2008 riguarda un meccanismo SN2 roundabout osservato in una reazione in fase gassosa tra ioni cloruro e ioduro di metile con una tecnica speciale chiamata "cross molecular beam imaging". Quando gli ioni cloruro hanno una velocità sufficiente, l'energia degli ioni ioduro risultanti dopo la collisione è molto più bassa del previsto, e si teorizza che l'energia viene persa come risultato di un giro completo del gruppo metile intorno all'atomo di iodio prima che avvenga lo spostamento effettivo.
Pagine correlate
- Reazione di sostituzione
- Reazione SN1
Domande e risposte
D: Che cos'è la reazione SN2?
R: La reazione SN2 è una reazione di sostituzione nella chimica organica, in cui un nucleofilo attacca un centro elettrofilo carente di elettroni, espellendo un gruppo di partenza e poi sostituendolo in una sola fase.
D: Che tipo di reazione di sostituzione è la reazione SN2?
R: La reazione SN2 è un tipo di reazione di sostituzione nucleofila.
D: Quante specie reagenti sono coinvolte nella fase lenta e determinante della reazione SN2?
R: Due specie reagenti sono coinvolte nella fase lenta e determinante della reazione SN2.
D: Qual è il significato del nome "sostituzione nucleofila bimolecolare" per la reazione SN2?
R: Il nome "sostituzione nucleofila bimolecolare" per la reazione SN2 si riferisce al fatto che due specie reagenti sono coinvolte nella fase lenta e determinante della reazione.
D: Che cos'è un nucleofilo nel contesto della reazione SN2?
R: Un nucleofilo è una molecola o uno ione che dona una coppia solitaria di elettroni per formare un legame chimico.
D: Che cos'è un elettrofilo nel contesto della reazione SN2?
R: Un elettrofilo è una molecola o uno ione che accetta una coppia di elettroni per formare un legame chimico.
D: Come viene spesso chiamata la reazione SN2 dai chimici inorganici?
R: Tra i chimici inorganici, la reazione SN2 è spesso conosciuta come meccanismo di scambio.
Cerca nell'enciclopedia