Tavola periodica degli elementi: definizione, struttura e classificazione
Scopri la tavola periodica: definizione, struttura, gruppi e classificazione degli elementi. Guida chiara su periodi, gruppi, metalli, metalloidi e non metalli.
La tavola periodica degli elementi chimici è una rappresentazione ordinata di tutti gli elementi chimici noti. Nella tabella gli elementi sono disposti secondo il loro numero atomico, che aumenta da sinistra a destra e dall'alto in basso, a partire dal più piccolo, l'idrogeno. Il numero atomico di un elemento corrisponde al numero di protoni presenti nel nucleo di un atomo. La disposizione regolare degli elementi nella tavola riflette la periodicità delle loro proprietà chimiche e fisiche, nota come legge periodica; grazie a questa struttura è possibile confrontare e prevedere il comportamento degli elementi.
Struttura della tavola periodica
Gli elementi sono organizzati in periodi e gruppi. Una fila orizzontale è chiamata periodo e ogni periodo ha un numero (da 1 a 7/8 a seconda della rappresentazione). I periodi indicano il livello di energia principale degli elettroni; gli elementi in uno stesso periodo hanno numeri atomici consecutivi. Il primo periodo contiene solo 2 elementi: idrogeno ed elio. I periodi 2 e 3 contengono ciascuno 8 elementi, mentre i periodi successivi sono più lunghi perché coinvolgono il riempimento di sottolivelli diversi (s, p, d, f).
Una colonna verticale è chiamata gruppo. Nella tavola periodica standard ci sono 18 gruppi numerati da 1 a 18 secondo il sistema adottato dall'Unione Internazionale di Chimica Pura e Applicata (IUPAC). Gli elementi dello stesso gruppo hanno configurazioni elettroniche esterne simili, cioè lo stesso numero di elettroni di valenza, e per questo mostrano proprietà chimiche simili. Ad esempio, il gruppo 18 è noto come gas nobile perché i suoi membri sono gas poco reattivi e tendono a non combinarsi con altri atomi.
Per chiarezza di lettura la tavola viene spesso suddivisa in blocchi elettronici:
- Blocco s (gruppi 1–2): elementi con elettroni esterni nel sottolivello s;
- Blocco p (gruppi 13–18): contiene i non metalli e molti metalloidi;
- Blocco d (gruppi 3–12): corrisponde ai metalli di transizione;
- Blocco f: comprende i lantanidi e gli attinidi (generalmente mostrati come due file separate sotto la tabella principale) e deriva dal riempimento degli orbitali f.
Classificazione degli elementi
Gli elementi della tavola periodica si possono raggruppare in tre categorie principali: metalli, metalloidi e non metalli. In generale:
- I metalli (in basso a sinistra della tavola) sono di solito lucenti, malleabili, duttili e buoni conduttori di calore ed elettricità (ad esempio il cesio è molto metallico rispetto a elementi come l'elio).
- I non metalli (in alto a destra) comprendono gas, liquidi e solidi fragili, con scarsa conducibilità elettrica.
- I metalloidi hanno proprietà intermedie tra metalli e non metalli e spesso mostrano comportamento semiconduttore.
Altre famiglie importanti nella tavola periodica:
- Alcalini (gruppo 1, molto reattivi con l'acqua)
- Alcalino-terrosi (gruppo 2)
- Alogeni (gruppo 17, non metalli fortemente reattivi)
- Metalli di transizione (blocchi d)
- Lantanidi e attinidi (serie f, spesso poste separatamente)
Tendenze periodiche
La tavola consente di osservare diverse tendenze regolari quando si muove attraverso periodi o gruppi:
- Raggio atomico: aumenta scendendo un gruppo e diminuisce procedendo lungo un periodo da sinistra a destra.
- Energia di ionizzazione: l'energia necessaria per rimuovere un elettrone; generalmente diminuisce scendendo un gruppo e aumenta lungo un periodo verso destra.
- Elettronegatività: tendenza di un atomo ad attrarre elettroni in un legame chimico; aumenta lungo un periodo verso destra e diminuisce scendendo un gruppo.
- Affinità elettronica: varia con il posizionamento nella tavola ed è correlata alla facilità con cui un atomo accetta un elettrone.
Storia e sviluppo
La tavola periodica moderna ha origine dagli studi di diversi scienziati, ma fu il chimico russo Dmitry Ivanovich Mendeleyev (1834–1907) a formulare, nel 1869, una versione che ordinava gli elementi per proprietà chimiche e lasciava spazi vuoti per elementi ancora da scoprire. La capacità di Mendeleyev di predire le proprietà di elementi ignoti rese la sua versione particolarmente influente. In suo onore è stato denominato l'elemento 101, il mendelevio.
Nel corso del XX e XXI secolo la tavola è stata aggiornata man mano che venivano scoperti o sintetizzati nuovi elementi. Attualmente l'IUPAC riconosce 118 elementi chimici confermati e assegna loro nomi e simboli ufficiali. L'IUPAC ha anche stabilito il sistema di numerazione dei gruppi in numeri arabi (1–18) per un uso uniforme a livello internazionale; in passato si utilizzavano sistemi con numeri romani o notazioni miste.
Elementi sintetici, isotopi e stabilità
Molti elementi con numero atomico elevato sono stati prodotti artificialmente in laboratorio mediante reazioni nucleari. Questi elementi sintetici spesso hanno isotopi molto instabili con emivite molto brevi; alcuni decadono in poche frazioni di secondo, altri possono persistere più a lungo. La chimica e la fisica di questi elementi sono oggetto di ricerche avanzate per comprendere la struttura nucleare e i limiti della materia ordinaria.
Uso e importanza
La tavola periodica è uno strumento fondamentale per i chimici, i fisici, gli ingegneri e gli studenti. Serve a:
- predire il tipo di legami e le reattività degli elementi;
- organizzare i materiali in base alle proprietà fisiche e chimiche;
- fornire un quadro di riferimento per ricerche e applicazioni tecnologiche (materiali, catalisi, semiconduttori, medicina, ecc.).
In sintesi, la tavola periodica è più di un semplice elenco: è una mappa delle proprietà atomiche che mette in relazione struttura elettronica e comportamento chimico, rendendo possibile la previsione e la scoperta scientifica.
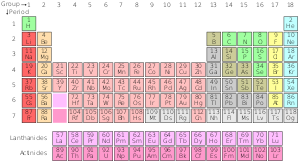
La variazione standard della tavola periodica
Tavola periodica standard
| Gruppo → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 12 | 13 | 14 | 15 | 16 | 17 | ||||
| 1 | 2 | |||||||||||||||||||
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||||||||||||
| 3 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||
| 4 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | 35 | 36 | ||
| 5 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | 45 | 46 | 47 | 48 | 49 | 50 | 51 | 52 | 53 | 54 | ||
| 6 | 55 | 56 | * Lantanidi | 72 | 73 | 74 | 75 | 76 | 77 | 78 | 79 | 80 | 81 | 82 | 83 | 84 | 85 | 86 | ||
| 7 | 87 Fr | 88 | ** Attinidi | 104 | 105 | 106 | 107 | 108 | 109 | 110 | 111 | 112 | 113 | 114 | 115 | 116 | 117 | 118 | ||
| 8 | 119 Uue | 120 Ubn | *** Superactinidi | |||||||||||||||||
| * Serie di lantanidi | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |||||
| ** Serie di attinidi | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 | |||||
| *** Serie Superactinide | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129Ube | 130Utn | 131Utu | 132Utb | 133Utt | 134Utq | 135Utp | |||||
| *** Serie Superactinide | 136Uth | 137Uts | 138Uto | 139Ute | 140Uqn | 141Uqu | 142Uqb | 143Uqt | 144Uqq | 145Uqp | 146Uqh | 147Uqs | 148Uqo | 149Uqe | 150Upn | |||||
| *** Serie Superactinide | 151Upu | 152Upb | 153Upt | 154Suq | 155Upp | 156Uf | 157Ups | 158Upo | 159Upe | 160Uhn | 161Uhu | 162Uhb | 163Uht | 164Uhq | 165Uhp | |||||
| *** Serie Superactinide | 166Uhh | 167Uh | 168Uho | 169Uhe | 170Uni | 171Usu | 172Usb | 173Ust | 174Uq | 175Usp | 176Ush | 177Uss | 178Uso | 179Uso | 180Uon | |||||
| *** Serie Superactinide | 181Uou | 182Uob | 183Uot | 184Uoq | 185Uop | 186Uoh | 187Uos | 188Uoo | 189Uoe | 190Uen | 191Ueu | 192Ueb | 193Uet | 194Ueq | 195Uep | |||||
| *** Serie Superactinide | 196Ueh | 197Ues | 198Ueo | 199Uee | 200Bnn | 201Bnu | 202Bnb | 203Bnt | 204Bnq | 205Bnp | 206Bnh | 207Bns | 208Bno | 209Bne | 210Bun | |||||
| *** Serie Superactinide | 211Buuu | 212Bub | 213 Ma | 214Buq | 215Bup | 216Buh | 217Bus | 218Buo | 219Bue | 220Bbn | 221Bbu | 222Bbb | 223Bbt | 224Bbq | 225Bbp | |||||
Serie chimica della tavola periodica
- Metalli alcalini
- Terre alcaline
- Lantanidi
- Attinidi
- Superactinidi
- Metalli di transizione
- Metalli poveri
- Non metalli
- Alogene
Dichiarare a temperatura e pressione standard. Il colore del numero (numero atomico) sopra il simbolo dell'elemento mostra lo stato dell'elemento in condizioni normali.
- quelli in blu sono gas
- quelli in verde sono liquidi
- quelli in nero sono solidi
- Quelli con bordi solidi hanno isotopi stabili (elementi primordiali)
- Quelli con i bordi tratteggiati hanno solo isotopi radioattivi naturali
- Quelli con i bordi punteggiati non sono naturali (Elementi Sintetici)
- quelli senza frontiere sono troppo radioattivi per essere stati scoperti.
Altri metodi di visualizzazione degli elementi chimici
La versione della tavola periodica sopra riportata è quella più utilizzata. Di seguito sono riportate le altre versioni più diffuse:
· 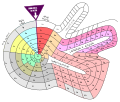
Theodor Benfey ha disposto gli elementi in una spirale, intorno all'idrogeno. Il peso atomico determina la posizione dell'elemento.
· 
Dmitry Ivanovich Mendeleyev ha usato una composizione floreale; Actinides, Lanthanides sono mostrati come anelli accanto al gruppo principale.
· 
Timothy Stove ha disposto gli elementi per numero quantico.
· ![]()
Betterman ha disposto gli elementi in base alle loro proprietà isoelettriche, che possono essere convertiti in forma polinomiale.
· 
Versione triangolare, di Zmaczynski e Bayley
· 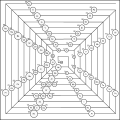
Disposto in una piramide.
Versioni utilizzate meno
- La tabella standard fornisce le basi. E' mostrata sopra
- Una tabella verticale per una migliore leggibilità nei browser web
- La grande tabella fornisce le basi e i nomi completi degli elementi
- L'enorme tabella fornisce le basi più i nomi completi degli elementi e le masse atomiche
- Configurazioni degli elettroni
- Metalli e non metalli
- Elenco degli elementi: include nome, simbolo, numero atomico, massa atomica, gruppo e periodo; ordinabile per uno qualsiasi di questi
- Elenco degli elementi per simbolo
- Elenco degli elementi per punto di ebollizione
- Elenco degli elementi per punto di fusione
- Elenco degli elementi per densità
Pagine correlate
- Gruppo di tavole periodiche
- Periodo della tavola periodica
- Tavola periodica estesa
Domande e risposte
D: Cos'è la tavola periodica?
R: La tavola periodica è una tabella che dispone tutti gli elementi chimici conosciuti in ordine di numero atomico, partendo dall'idrogeno al numero uno. Gli elementi con caratteristiche simili sono spesso collocati l'uno vicino all'altro.
D: Quanti periodi e gruppi ci sono nella tavola periodica standard?
R: Ci sono 8 periodi e 18 gruppi nella tavola periodica standard.
D: Che cosa hanno in comune gli elementi di un periodo?
R: Gli elementi di un periodo hanno numeri atomici consecutivi.
D: Cosa hanno in comune gli elementi di un gruppo?
R: Gli elementi di un gruppo hanno elettroni disposti in modo simile, in base al numero di elettroni di valenza, il che conferisce loro proprietà chimiche simili.
D: Chi ha inventato la tavola periodica?
R: Il chimico russo Dmitry Ivanovich Mendeleyev inventò la tavola periodica (1834-1907).
D: Quali sono i tre gruppi principali della Tavola Periodica?
R: I tre gruppi principali della Tavola Periodica sono i metalli, i metalloidi e i non metalli.
D: Come si possono osservare i modelli e le relazioni tra gli elementi utilizzando la Tavola Periodica?
R: I modelli e le relazioni tra gli elementi possono essere osservati osservando la loro posizione sulla Tavola Periodica; ad esempio, gli elementi in basso a sinistra tendono ad essere più metallici di quelli in alto a destra.
Cerca nell'enciclopedia